药品专利补交实验数据的问题研究及审理建议
来源:wxw 发布日期:2022-12-28 浏览:77001
引 言
2021年1月15日开始实施的《专利审查指南》修改内容进一步明确了补交实验数据的审查原则,并且增加了两个药品领域的案例予以举例说明补交实验数据可被接受的审查标准,形成具有普遍性与指导性的原则。
事实上,关于补交实验数据审查标准自2020年初已经出现了积极的变化:中美双方于2020年1月正式签署的《中华人民共和国政府和美利坚合众国政府经济贸易协议》(简称中美贸易协定)中,针对“药品相关的知识产权”作出规定,特别强调允许专利申请时补充数据、要求建立专利纠纷早期解决的有效机制。而后,同年9月份开始实施的《最高人民法院关于审理专利授权确权行政案件适用法律若干问题的规定(一)》(简称《专利确权司法解释(一)》)中,第十条也明确对“药品专利申请”中关于补交实验数据的问题进行了规定:药品专利申请人在申请日以后补交实验数据,主张依赖该数据证明专利申请符合专利法第二十二条第三款、第二十六条第三款等规定的,人民法院应予审查。
基于上述系列协议、规定中呈现出的高度一致的“药品专利补交实验数据”观点,也间接表明最高人民法院和国家知识产权局对于补交实验数据的审查标准开始呈现更为统一的趋势。
02
药品专利补交实验数据的特殊性
2.1 药品行业的特殊性
不同于其他领域的产品一经生产即可迅速投放市场,药品行业极具特殊性。除了众所周知的上市之前的新药研发时间长、失败率高、风险大等特点,[1][2]新药上市后的临床使用过程中,极有可能存在NDA(NewDrugApplication,NDA)申请阶段无法发现的安全性盲点,而这些盲点会直接导致药品被强制撤市。近两年以来,药品撤回事件接连发生,其中包括适应症“四连撤(罗氏、默沙东、阿斯利康、BMS)”的PD-1/L1,以及阿斯利康的新冠疫苗(AstraZeneca ,AZ疫苗)。

正是由于医药企业需要承担上述的高成本、高风险,才使得药品需要依靠专利获得强有力的保护,保证医药企业能够以“垄断式”的姿态维持其所售药品的高价格,进而保证其前期资本投入得以回收并带来高额利润,激发医药企业的新药研发动力。
2.2 药品专利的特殊性
专利是守护医药企业研发成果的城墙,以化药企业为例,其命脉往往就是早期研发阶段中形成的通式或具体化合物专利。针对专利申请,世界各国普遍实行“先申请原则”,加之企业之间天然存在竞争特性,为了抢占先机,医药企业通常都会在药品研发的早期阶段就针对药品的核心成果进行专利申请和布局,同时由于不同国家或地区的专利审查标准存在差异,药品领域的专利申请文件,往往具有以下特性:
(1)申请日掌握的实验数据有限,申请日前尚未进行系统的临床实验,仅掌握有初步的药效实验数据;无法提供与药品毒性、药效活性、代谢稳定性以及给药途径等方面的深入、全面的研究数据;也无法确定药品的优选方案;
(2)申请文件中存在部分声称却缺乏实验数据的技术效果,旨在通过后续的研究获得支持上述技术效果的数据。
2.3 药品专利实验数据的特殊性
之所以“申请日后补交实验数据的问题”能够成为药品类专利审查标准的关注重点,不仅取决于药品行业、药品专利的特殊性,另一重要的原因在于药品专利的实验数据所具有的特殊性:
其一、其药效难以通过药品分子结构预测,必须结合实验结果来证实。例如,瑞士CIBA公司研发的沙利度胺(Thalidomide,CAS号:50-35-1,化学名称:N-(2,6-二氧代-3-哌啶基)-邻苯二甲酰亚胺),其左旋异构体(R型)对妊娠期孕妇具有镇静止吐的作用,而右旋异构体(S型)对婴儿具有强烈的致畸作用,仅手性原子构型的不同即可能产生完全不同的药效或药品毒性。
其二、药品的考察标准多维、且过程复杂、周期长,单就药品临床试验一般就包括I、II、III、IV期临床试验及生物等效性试验。I期临床试验涉及安全性、毒性、药代动力学及耐受性(最大耐受剂量)的考察;II期临床试验涉及药品有效性及受益/风险比、耐受性(最小耐受剂量)的考察;III期临床试验涉及药品对目标适应症患者的治疗作用和安全性验证,观察不常见或迟发的不良反应,获取更丰富的药品安全性和疗效方面的资料,确定理想用药剂量方案;IV期临床试验考察广泛使用条件下的药品疗效和罕见不良反应,在普通人群或特殊人群中使用的受益及风险关系,改进给药剂量,以及发现新的适应症[3];生物等效性试验以药代动力学参数为指标,比较同一种药品的相同或者不同剂型的制剂,在相同的试验条件下,其活性成份吸收程度和速度有无统计学差异的人体试验[4]。
基于上述,涵盖适应症种类以及针对每一适应症的治疗效果均可以视为药品类专利的技术效果,比如高活性、低毒性、缓释性、给药途径、储存稳定性、易加工性等,均可以作为药品专利应予考虑和接受的技术效果。由此药品专利的实验数据呈现出了与其他技术领域不同的特点。
03
我国关于补交实验数据的规定研究
3.1 《专利审查指南》关于补交实验数据的规定
关于申请日之后补交提交实验数据的问题,并未记载在我国现行的《专利法》及《专利法实施细则》中,而记载在《专利审查指南》中。随着我国经济社会的发展,《专利审查指南》中关于补交实验数据的问题也经历了长久、反复的变化过程。
如图3所示,自1993年至2017年各版的《专利审查指南》,关于申请日后补交实验数据的相关规定,经历了由“允许”-“提供”-“记载”-“得到”四个阶段。补交实验数据的情形,经历了由“宽松”到“严格”,再由“严格”到“宽松”的状态。
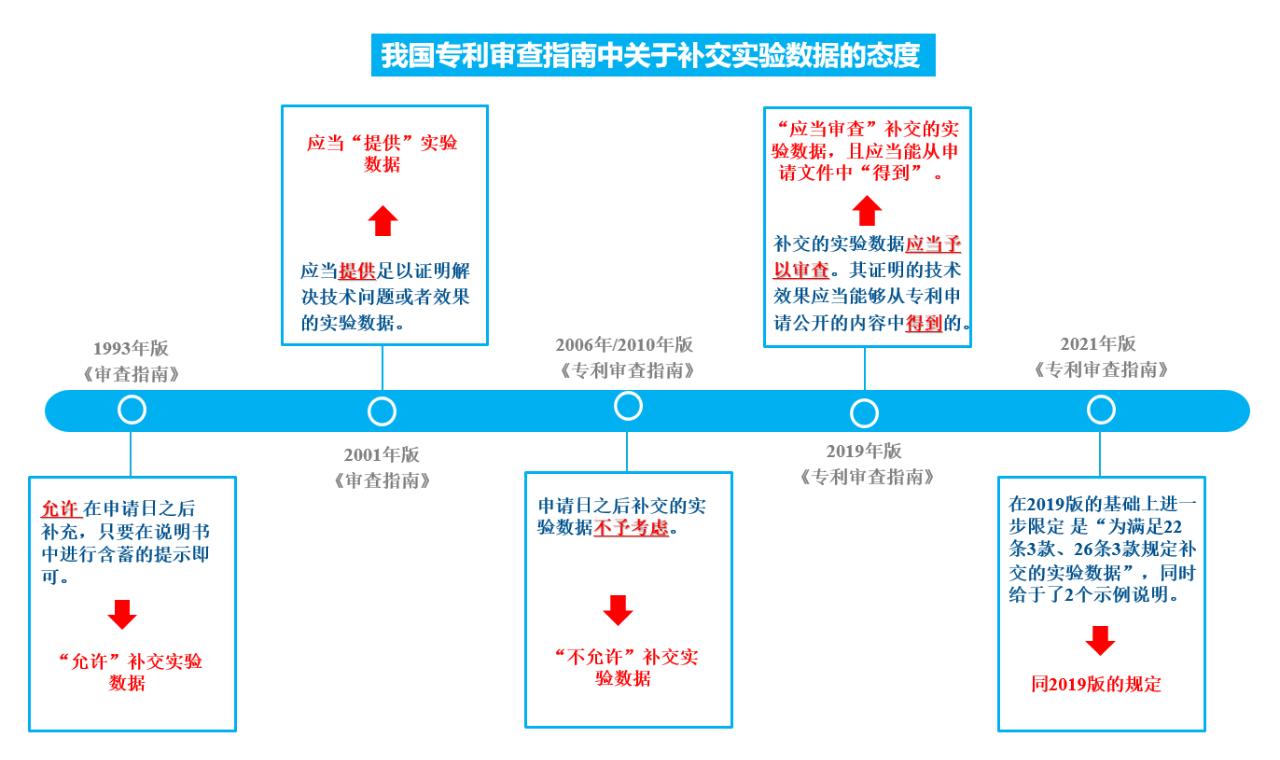
图3 我国专利审查指南中关于补交实验数据的态度
2019年版的《专利审查指南》对申请日之后补交实验数据的问题进行了修改,首先明确对补交的实验数据应当予以审查,其次又明确规定了补交的实验数据所能被接受的要求,即“补交实验数据所证明的技术效果应当是所属技术领域的技术人员能够从专利申请公开的内容中得到的”;2021年版的《专利审查指南》在2019年版的基础上,进一步的把补交实验数据能够被接受的要求限定在用于证明《专利法》第22条3款创造性、第26条3款公开充分两个方面;并且《专利审查指南》在第3.5.2节中给出了两个典型审查示例,分别涉及说明书充分公开和创造性审查中有关补交实验数据的典型情形,为补交的实验数据的审查提供了具有参考性的案例和借鉴标准。
3.2 司法程序关于补交实验数据的规定
最高人民法院于2021年9月的《专利确权司法解释(一)》也对申请日之后补交实验数据的问题予以确认。《专利确权司法解释(一)》的第十条,规定药品专利申请人在申请日以后补交实验数据,主张依赖该数据证明专利申请符合专利法第二十二条第三款、第二十六条第三款等规定的,人民法院应予审查。
基于新的司法解释,最高人民法院于2020年10月26日作出(2019)最高法知行终33号判决[5],该判决中最高人民法院认为:“基于对现有技术的认知差异、对技术方案发明点的理解不同、对本领域技术人员认知水平的把握不一致等,申请人在原申请文件中未记载特定实验数据的情形是难以避免的……上述情况下,专利申请人均需要依靠在申请日或者优先权日之后提交的补交实验数据证明其专利申请符合授权条件”。因此,最高人民法院认为申请日之后提交的补交实验数据应当予以审查。
3.3 相关规定与我国医药企的发展相适应
我国自1993年至2017年经过多次对补交实验数据规定的修改,逐渐有与美国等发达国家接轨的趋势,要求实验数据要能从原始文件中“得到”,但总体上的要求还是偏于严格。后续,美国贸易代表办公室(简称USTR)接连于2018年至2020年的《特别301报告》[6][7][8]中对中国药品专利申请及审查方面补交实验数据的问题进行提及。至此,我国关于补交实验数据的审查标准也于2020年开始出现“逐渐放开”的变化。
我国对于补交实验数据审查标准的变化,固然有来源于欧美等地区外在压力的影响,但主要还是取决于我国制药产业发展的客观需要。从2009年~2018年,我国本土企业的(一类)上市新药仅有20个[9],而2019年~2021年我国本土企业上市新药达到48个,这说明我国药企的自主研发能力逐渐增强,中国医药企业在国际产业价值链的地位也不断提升,我国越来越多的创新药企业也需要得到更强力度的专利保护,从而才能更好依靠专利权在特定时间的垄断而激发创新药企业的创新动力。因此,我国针对补交实验数据的审查标准的变化也是为了更好的促进我国医药产业的创新发展。
04
针对补交实验数据审理建议
补交实验数据是否予以接受是医药专利授权和确权程序的关键所在,补交实验数据是否采纳关乎到专利权人利益与社会公众利益之间的平衡,必须要在维护“先申请原则”的基础上保证专利权人的利益。虽然,为了适应我国医药产业的发展、激发药企的创新活力,最高人民法院和国家知识产权局针对补交实验数据的标准都逐渐宽松,但目前补交实验数据的证明规则尚不明确。因此,建议针对补交的实验数据采取“实验数据的审查”-“实验数据的采纳”-“待证事实的证明力”的三步法进行判断。
4.1 针对补交实验数据的审查
2021年版的《专利审查指南》及2020年9月10日发布的《专利确权司法解释(一)》,均明确了在申请日或者优先权日之后补交实验数据应当予以审查,为申请人在原申请文件中未记载特定实验数据的情形提供了救济途径,从而保证专利权人在授权或者确权过程中针对补交实验数据的发言权,避免出现针对补交实验数据不予审理和不予认可的情形发生。
同时对补交实验数据的真实性、合法性进行审理,排除非法证据和真实性存疑的证据。针对补交的实验数据,如果具有权威第三方中立机构检测报告以及送检过程公证记录则认为具有较强的可信度,或者申请人提交的原始实验记录、原始检测结果和研发过程记录也可以提高证据的可信度。
但是,法院及国家知识产权局的审查人员不能武断要求申请人提交的补交实验数据必须形成于申请日或者优先权日之前。此外,也不能以补交实验数据的来源与专利权人具有雇佣等利害关系作为拒绝的绝对理由。
4.2 针对补交实验数据的采纳
在审查的基础上对补交实验数据进行进一步的分析,从而判断补交的实验数据是否予以采纳。
(1)应当分析补交的实验数据是否违反先申请原则,避免专利申请人将申请日以后的内容补充到原始申请文件中;如果申请日后补交的实验数据会导致增加和/或改变原始申请文件中所记载的专利权保护范围,或者企图弥补原专利申请文件存在的公开不充分等固有内在缺陷,则补交的实验数据均不应该被接受。
(2)需要审查所补交的实验数据能否从原始申请文件中得到,即补交实验数据所证明的技术效果应当是原始申请文件中已经记载或者隐含公开的具体活性或者药效,而并非通过申请日补交实验数据从众多可能的优势效果中确认选择一种特定活性或者药效;而且,补交实验数据所证明的技术效果应当是针对申请文件中具体化合物的技术效果,避免通过补交实验数据从包含多个化合物的通式中筛选优选化合物的情形。
(3)对补交实验数据整体的逻辑性进行判断,首先分析补交实验数据是否符合药品的研发规律和研发实践;其次结合最接近现有技术、原始申请文件中记载的内容和专利权利要求请求保护技术方案的范围共同分析实验数据的逻辑性,进而确定补交的实验数据是否予以采纳,对违反研发逻辑或者技术逻辑的实验数据不予接受。
<

